SARS-CoV-2 iSpot
Das zelluläre Immunsystem und insbesondere die T-Zellen steuern die Stärke der Immunreaktion durch die Ausschüttung von Zytokinen, um die Antwort je nach Viruslast zu erhöhen oder zu unterdrücken. Der Nachweis von reaktiven T-Zellen (Effektorzellen) gegen einen Erreger, weist auf einen Kontakt und folglich eine akute oder zurückliegende Infektion hin, unabhängig ob Antikörper gebildet wurden.
Interessant ist vor allem, dass die T-Zell Reaktionen gegen SARS-CoV über einen längeren Zeitraum als Antikörpertiter nachgewiesen werden können.
Der EliSpot-Assay (Enzyme-linked Immuno-Spot Assay) ist in der Lage, T-Zell-Reaktionen auf Einzelzellebene nachzuweisen und damit die individuelle Immunantwort von infizierten Personen zu charakterisieren. Der Nachweis einer Zytokinausschüttung von T-Zellen, die mit spezifischen Coronavirus-Antigenen stimuliert werden, ergibt ein differenziertes Bild der Immunantwort, um die Entwicklung des Krankheitsverlaufs und der Immunität nach einer Infektion darzustellen.
Schreiben Sie uns einfach eine Email an info@arminlabs.com oder rufen Sie uns an unter der 0821 780 931 50 .
Vorteile des SARS-CoV-2 iSpot
- effektiver, indirekter Nachweis einer vorangegangenen COVID-19-Erkrankung
- differenziertes Bild der Immunantwort, um die Entwicklung des Krankheitsverlaufs und der Immunität nach einer Infektion darzustellen
- modernes zelluläres Testverfahren um zwischen Influenza und COVID-19-Infektionen unterscheiden zu können
- zelluläre Basisimmunität sehr wahrscheinlich - Frage nach einer Basisimmunität durch das zelluläre Immunsystem nach vorangegangenem Kontakt mit weltweit endemischen Coronaviren
- beim Nachweis SARS-CoV-2-spezifische T-Zellklone, ist das nicht nur ein Beweis für einen vorangegangenen Viruskontakt, der Befund kann auch für eine vorhandene zelluläre Immunität sprechen
Der pandemische Ausbruch SARS-CoV-2 und seine Auswirkungen auf die Weltbevölkerung, zeigt die essenzielle Notwendigkeit an Testverfahren, die Infektionsverläufe abbilden können. Die besondere Bedeutung liegt in den damit verbundenen Diagnose-, Prognose- und Therapieansätzen. Eine vollständige Diagnostik, die alle Säulen des Immunsystems betrachtet, ist im Hinblick auf die Bestimmung der Immunität gegenüber SARS-CoV-2 unabdingbar, um zukünftig gezielte Maßnahmen bei erneuten lokalen Ausbrüchen einzuleiten.
Die Infektion läuft bei den meisten Betroffenen klinisch asymptomatisch oder moderat ab. In einigen Fällen verursacht die Infektion jedoch einen schweren Verlauf, der bis zum Tod führen kann.
Neben der etablierten RT-PCR zur Bestätigung einer akuten Infektion ist der Nachweis der humoralen Immunantwort gegen SARS-CoV-2 Teil der Diagnose. Mit ELISA Testsystemen werden Antikörpernachweise geführt. Diese sind im Hinblick einer möglichen Immunität, sowie individuell schnell abfallender Antikörpertiter jedoch bei den Fachkreisen hinsichtlich ihrer Aussagekraft in starker Diskussion.
Als weitere Säule zu einer vollständigen Diagnostik kann das zelluläre Immunsystem getestet werden. Während Antikörper sich an Krankheitserreger wie Viren und Bakterien anlagern und diese zerstören, lagern sich T-Zellen an kranke Zellen im Körper an, wie z.B. Tumorzellen oder virusinfizierte Zellen. T-Zellen helfen auch dabei, andere Immunzellen in das Gebiet zu holen.
Der von der Firma AID entwickelte CoV-iSpot weist die IFN-γ und IL-2-Reaktionen von erregerspezifischen aktivierten T-Zellen gegen SARS-CoV-2 (SARS-CoV-2 Peptid-Mix) und Coronaviridae im Allgemeinen (PAN-Corona Peptid-Mix) nach. Der von AID entwickelte SARS-CoV-2 Peptid-Mix enthält nur hochspezifische Sequenzen der immundominanten Epitope von SARS-CoV-2. Zur Abgrenzung zu anderen Coronaviren ist ein zweiter Peptid Mix mit spezifischen Sequenzen konservierter Regionen innerhalb der Familie der Coronaviridae (PAN-Corona Peptid Mix) im CoV-iSpot enthalten.
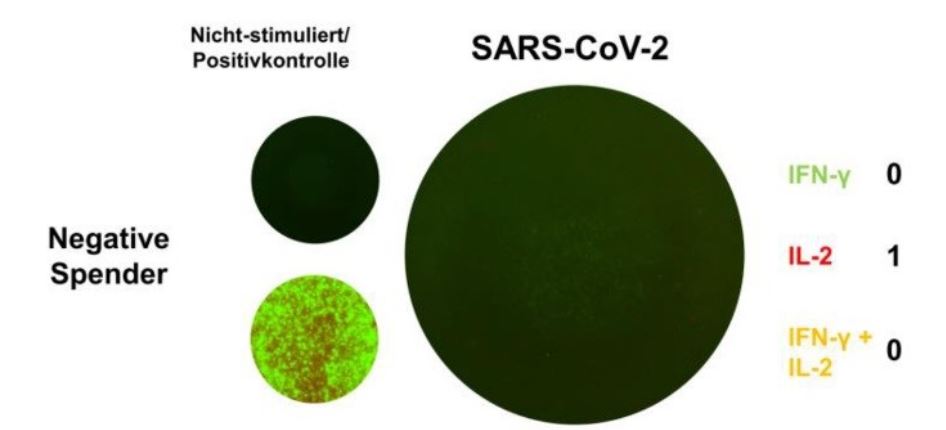
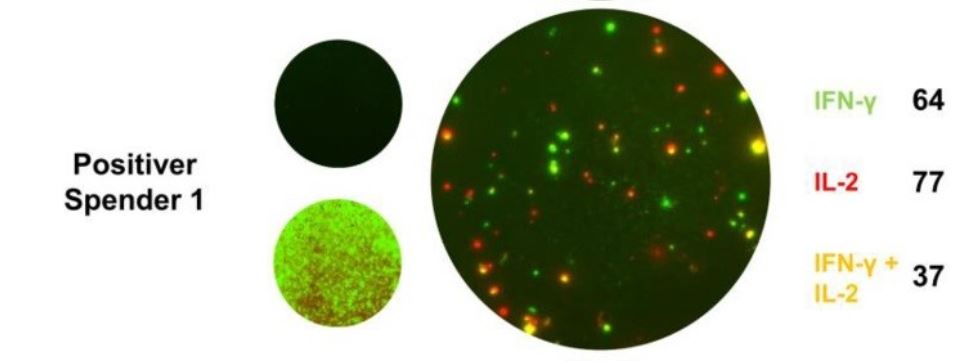
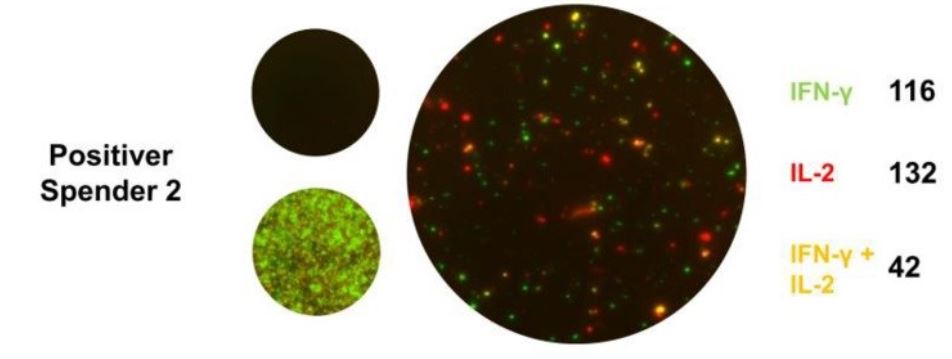
Der Nachweis von reaktiven T-Zellen (Effektorzellen) gegen einen Erreger, wie zum Beispiel SARS-CoV-2, weist auf einen Kontakt und folglich eine akute oder zurückliegende Infektion hin, unabhängig ob Antikörper gebildet wurden.
Interferon Gamma ist ein proinflammatorisches Zytokin, das hauptsächlich von aktivierten T-Zellen und NK-Zellen gebildet wird. Eine Freisetzung von IFN-γ durch Effektorzellen, weist als Leitzytokin auf eine TH1 dominante Immunantwort hin
Interleukin 2 reguliert die Aktivitäten der T-Lymphozyten. Es fördert die Aktivierung und Expansion von T-Zellen und die Differenzierung von CD8+ T-Zellen zu Gedächtniszellen. Im CoV-iSpot lässt der alleinige Nachweis von IFN-γ produzierenden Effektorzellen auf eine Immunreaktion im Rahmen einer SARS-CoV-2-Infektion schließen. Der Nachweis von IL-2 oder die gleichzeitige Detektion von IFN-γ und IL-2 sprechen für das Vorhanden Sein von Gedächtniszellen als Hinweis auf eine zurückliegende SARS-CoV-2-Infektion mit eventueller zellulärer Immunität.
Klinische Relevanz
Die erworbene Immunabwehr unterscheidet sich grundsätzlich in der humoralen und zellulären Immunantwort. Die zelluläre Immunantwort ist T-Zell abhängig. Die T-Zellen unterteilen sich in verschiedene Subpopulationen (z. Bsp. Th1 und Th2), die speziell nach ihrer Funktion, verschiedene Zytokine ausschütten. Ein Teil dieser Zytokine setzt die humorale Immunantwort in Gang. Die T-Zellen stehen somit am Anfang der erworbenen Abwehrmechanismen. Die verschiedenen T-Zell-Subpopulationen bilden die zentrale Stelle sowohl der humoralen, als auch der zellulären Immunantwort.
Effektor T-Zellen stellen direkt aktivierte und differenzierte T-Zellen dar, die entzündungsfördernde Eigenschaften besitzen. Sie bilden sich aus naiven T-Zellen, nachdem sie im Rahmen einer Infektion oder Impfung mit dem entsprechenden Antigen in Kontakt gekommen sind. Nach der Differenzierung proliferieren sie zu erregerspezifischen T-Zellklonen, die als Effektor- und Gedächtnis T-Zellen im peripheren Blut zu finden sind. Regulatorische T-Zellen supprimieren die Immunantwort. Sie entstehen wie die Effektor T-Zellen durch Differenzierung aus naiven T-Zellen. Eine Balance zwischen aktivierten Effektor T-Zellen und regulatorischen T-Zellen ist entscheidend für eine effektive und schützende Immunreaktion. Ein gestörtes Verhältnis kann die Grundlage einer Autoimmunerkrankung oder eines chronischen Entzündungsverlaufs sein.
Die EliSpot Methode bietet die Möglichkeit, einen Einblick in diese regulatorischen Vorgänge zu bekommen. Ihr Einsatz ist sehr vielfältig, es lassen sich sowohl akute Erkrankungen als auch chronisch entzündliche Prozesse darstellen. Ebenso ist eine Therapieüberwachung möglich.
Indikationen
Indirekter Nachweis einer vorangegangenen COVID-19-Erkrankung
Vor allem bei asymptomatischen Patienten oder Patienten mit leichten Symptomen finden sich oft keine oder nur geringe Antikörper Titer, die häufig schnell wieder abnehmen. Viele Menschen zerstören das Corona-Virus bereits durch ihr zelluläres Immunsystem, bevor Antikörper gebildet werden. Durch den Nachweis von SARS-CoV-2-spezifischen T-Effektor- oder Gedächtniszellen lassen sich vorangegangene COVID-19-Infektionen effektiv nachweisen.
Nachweis einer zellulären Immunität
Lassen sich SARS-CoV-2-spezifische T-Zellklone nachweisen, ist das nicht nur ein Beweis für einen vorangegangenen Viruskontakt, der Befund kann auch für eine vorhandene zelluläre Immunität sprechen. Dies ist vor allem dann der Fall, wenn sich über den Nachweis von IL-2 oder einem kombinierten Nachweis von IL-2 und INF-γ Hinweise auf Gedächtniszellen zeigen. Ersten Studien zufolge bleiben SARS-CoV-2-spezifische T-Zellantworten im CoV-iSpot lange nachweisbar. Relativ kurzlebige Antikörperantworten, aber eine langanhaltende T-Zell-Immunität, die dazu führt, dass bei SARS-Patienten von 2003 auch im Jahr 2020 noch SARS-spezifische T-Gedächtniszellen gefunden werden konnten.
Hinweis auf eine mögliche Basisimmunität
Im CoV-iSpot werden zusätzlich andere humanpathogenen Coronaviridae zur Stimulation der Lymphozyten eingesetzt, um die Frage nach einer Basisimmunität durch das zelluläre Immunsystem nach vorangegangenem Kontakt mit weltweit endemischen Coronaviren zu klären. Finden sich im CoV-iSpot Hinweise auf PAN-Corona-spezifische T-Zellantworten und erkranken diese Patienten nicht oder nur mit milden Symptomen nach einer SARS-CoV-2-Infektion, dann scheint eine zelluläre Basisimmunität sehr wahrscheinlich. Für eine zelluläre Basisimmunität spricht auch die Beobachtung, dass Patienten mit reagierendem PAN-Corona-Peptid-Ansatz oft keine SARS-CoV-2-Antikörper zeigen. Virusinfizierte Zellen werden dabei durch T-Effektorzellen eliminiert, bevor es über eine Anregung von Plasmazellen zur Antikörperbildung kommt.
Bevorstehende Grippesaison
Die bevorstehende Grippesaison wird die Testzahlen von SARS-CoV-2 Verdachtsfällen wahrscheinlich auf neue Höchststände ansteigen lassen. Mit dem CoV-iSpot haben wir ein modernes zelluläres Testverfahren um zwischen Influenza und COVID-19-Infektionen unterscheiden zu können. Insbesondere die neueren Erkenntnisse über eine potentielle zelluläre Immunität gegen SARS-CoV-2 und eine vermutlich bestehende Basisimmunität durch kreuzreagierende T-Zellen könnten zusätzliche Sicherheit geben.
Referenzen
- Peng Y, Mentzer AJ, Liu G, et al. Broad and strong memory CD4 + and CD8 + T cells induced by SARS-CoV-2 in UK convalescent individuals following COVID-19. Nature Immunology. Published online September 4, 2020:1-10. doi:10.1038/s41590-020-0782-6 http://nature.com/articles/s41590-020-0782-6
- Maisch B. SARS-CoV-2 as potential cause of cardiac inflammation and heart failure. Is it the virus, hyperinflammation, or MODS? Herz. 2020;45(4):321-2
- Grifoni A, Weiskopf D, Ramirez SI, Mateus J, Dan JM, Moderbacher CR, et al. Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell. 2020;181(7):1489-501.e15.
- Braun J, Loyal L, Frentsch M, Wendisch D, Georg P, Kurth F, et al. Presence of SARS-CoV-2 reactive T cells in COVID-19 patients and healthy donors. medRxiv. 2020:2020.04.17.20061440.
- Oberfeld B, Achanta A, Carpenter K, Chen P, Gilette NM, Langat P, et al. SnapShot: COVID-19. Cell. 2020;181(4):954-.e1.
- S. R. Huber, J. van Beek, J. de Jonge, W. Luytjes, and D. van Baarle, “T cell responses to viral infections - opportunities for peptide vaccination,” Frontiers in Immunology, vol. 5, no. APR. Frontiers Research Foundation, 2014, doi: 10.3389/fimmu.2014.00171.
- S. L. Swain, K. K. McKinstry, and T. M. Strutt, “Expanding roles for CD4 + T cells in immunity to viruses,” Nature Reviews Immunology, vol. 12, no. 2. Nature Publishing Group, pp. 136–148, Feb. 2012, doi: 10.1038/nri3152.
- J. Charles A Janeway, P. Travers, M. Walport, and M. J. Shlomchik, “T Cell-Mediated Immunity,” in Immunobiology: The Immune System in Health and Disease., 5th ed., Garland Science, 2001.
- H. Zhang, “INF-gamma Release ELISpot Assay,” Bio-Protocol, vol. 2, no. 6, 2012, doi: 10.21769/bioprotoc.120.
- C. Möbs and T. Schmidt, “Research Techniques Made Simple: Monitoring of T-Cell Subsets using the ELISpot Assay,” J. Invest. Dermatol., vol. 136, no. 6, pp. e55–e59, Jun. 2016, doi: 10.1016/j.jid.2016.04.009.
- M. F. Bachmann and A. Oxenius, “Interleukin 2: From immunostimulation to immunoregulation and back again,” EMBO Rep., vol. 8, no. 12, pp. 1142–1148, Dec. 2007, doi: 10.1038/sj.embor.7401099.
- S. Thijsen et al., “Elevated nucleoprotein-induced interferon-γ release in COVID-19 patients detected in a SARS-CoV-2 enzymelinked immunosorbent spot assay,” J. Infect., vol. 0, no. 0, 2020, doi: 10.1016/j.jinf.2020.06.015.
- T. Sekine et al., “Robust T cell immunity in convalescent individuals with asymptomatic or mild COVID-19,” bioRxiv, p. 2020.06.29.174888, Jun. 2020, doi: 10.1101/2020.06.29.174888.
- F. Gallais et al., “Intrafamilial Exposure to SARS-CoV-2 Induces Cellular Immune Response without Seroconversion,” medRxiv, p. 2020.06.21.20132449, Jun. 2020, doi: 10.1101/2020.06.21.20132449.
- D. M. Altmann and R. J. Boyton, “SARS-CoV-2 T cell immunity: Specificity, function, durability, and role in protection,”Sci. Immunol., vol. 5, no. 49, p. 6160, Jul. 2020, doi: 10.1126/sciimmunol.abd6160.
- R. A. Seder, P. A. Darrah, and M. Roederer, “T-cell quality in memory and protection: Implications for vaccine design,”Nature Reviews Immunology, vol. 8, no. 4. Nat Rev Immunol, pp. 247–258, Apr. 2008, doi: 10.1038/nri2274.
- A. Grifoni et al., “Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals,” Cell, vol. 181, no. 7, pp. 1489-1501.e15, Jun. 2020, doi: 10.1016/j.cell.2020.05.015.
- J. Zhao et al., “Airway Memory CD4+ T Cells Mediate Protective Immunity against Emerging Respiratory Coronaviruses,” Immunity, vol. 44, no. 6, pp. 1379–1391, Jun. 2016, doi: 10.1016/j.immuni.2016.05.006.
- R. Channappanavar, C. Fett, J. Zhao, D. K. Meyerholz, and S. Perlman, “Virus-Specific Memory CD8 T Cells Provide Substantial Protection from Lethal Severe Acute Respiratory Syndrome Coronavirus Infection,” J. Virol., vol. 88, no. 19, pp. 11034–11044, Oct. 2014, doi: 10.1128/jvi.01505-14.
- J. Zhao et al., “Recovery from the Middle East respiratory syndrome is associated with antibody and T cell responses,” Sci. Immunol., vol. 2, no. 14, p. 5393, Aug. 2017, doi: 10.1126/sciimmunol.aan5393.
- A. Nelde et al., “SARS-CoV-2 T-cell epitopes define heterologous and COVID-19-induced T-cell recognition,” Res. Sq., Jun. 2020, doi: 10.21203/rs.3.rs-35331/v1.
- V. M. Corman, J. Lienau, and M. Witzenrath, “Coronaviruses as the cause of respiratory infections,” Internist, vol. 60, no. 11, pp. 1136–1145, Nov. 2019, doi: 10.1007/s00108-019-00671-5.
- A. Sette and S. Crotty, “Pre-existing immunity to SARS-CoV-2: the knowns and unknowns,” Nat. Rev. Immunol., vol. 20, no. 8, pp. 457–458, Aug. 2020, doi: 10.1038/s41577-020-0389-z.
- G. J. Gorse, G. B. Patel, J. N. Vitale, and T. Z. O’Connor, “Prevalence of antibodies to four human coronaviruses is lower in nasal secretions than in serum,” Clin. Vaccine Immunol., vol. 17, no. 12, pp. 1875–1880, Dec. 2010, doi: 10.1128/CVI.00278-10.
- N. Friedman, H. Alter, M. Hindiyeh, E. Mendelson, Y. Shemer Avni, and M. Mandelboim, “Human Coronavirus Infections in Israel: Epidemiology, Clinical Symptoms and Summer Seasonality of HCoV-HKU1,” Viruses, vol. 10, no. 10, p. 515, Sep. 2018, doi: 10.3390/v10100515.
- I. M. Mackay et al., “Co-circulation of Four Human Coronaviruses (HCoVs) in Queensland Children with Acute Respiratory Tract Illnesses in 2004,” Viruses, vol. 4, no. 4, pp. 637–653, Apr. 2012, doi: 10.3390/v4040637.
- L. J. R. van Elden et al., “Frequent Detection of Human Coronaviruses in Clinical Specimens from Patients with Respiratory Tract Infection by Use of a Novel Real-Time Reverse-Transcriptase Polymerase Chain Reaction,” J. Infect. Dis., vol. 189, no. 4, pp. 652–657, Feb. 2004, doi: 10.1086/381207.
- I. M. Mackay and K. E. Arden, “MERS coronavirus: Diagnostics, epidemiology and transmission,” Virol. J., vol. 12, no. 1, pp. 1–21, Dec. 2015, doi: 10.1186/s12985-015-0439-5.
- A. Mailles et al., “First cases of middle east respiratory syndrome coronavirus (MERS-COV) infections in France, investigations and implications for the prevention of human-to-human transmission, France, May 2013,” Eurosurveillance, vol. 18, no. 24, p. 20502, Jun. 2013, doi: 10.2807/ese.18.24.20502-en.
- J. Mateus et al., “Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans,” Science (80-. )., p. eabd3871, Aug. 2020, doi: 10.1126/science.abd3871.
- D. Weiskopf et al., “Phenotype of SARS-CoV-2-specific T-cells in COVID-19 patients with acute respiratory distress syndrome 2 3 16,” medRxiv, p. 2020.04.11.20062349, May 2020, doi: 10.1101/2020.04.11.20062349.
- J. Braun et al., “SARS-CoV-2-reactive T cells in healthy donors and patients with COVID-19.,” Nature, pp. 1–8, Jul. 2020, doi: 10.1038/s41586-020-2598-9.
- N. Le Bert et al., “SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls,”doi: 10.1038/s41586-020-2550-z.
- Le Bert, N., Tan, A.T., Kunasegaran, K. et al. SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS and uninfected controls. Nature (2020). https://doi.org/10.1038/s41586-020-2550-z